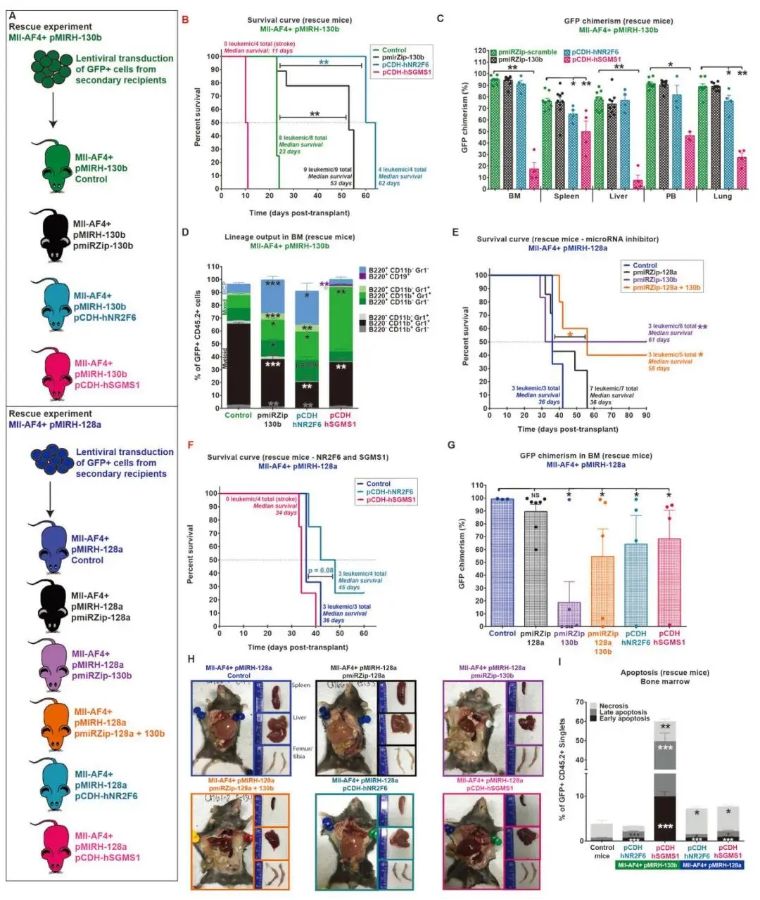
这项研究突出了疾病发展的新机制,主要集中在两个在原发性患者白血病细胞中上调的microRNA:miR-130b和miR-128a。研究发现miR-130b和miR-128a是MLL-AF4的下游靶点,并且可以在完全小鼠MLL-AF4体内模型中单独驱动从白血病前期到急性白血病的转变。它们也是维持疾病表型所必需的。miR-130b的过度表达导致了一种混合的/B细胞前体/髓系白血病,由淋巴诱导的多能祖细胞群繁殖,而miR-128a的过度表达导致了一种前B急性淋巴细胞白血病,由高度扩增的Il7r+ckit+blast群维持。
由这两种miRNAs诱导的分子和表型变化充分再现了人类疾病,包括中枢神经系统浸润和MLL-AF4表达特征的激活。此外,我们确定了这些小RNA的两个下游靶点,NR2F6和SGMS1,在广泛的验证研究中被证实是MLL-AF4+白血病的新型肿瘤抑制因子。因此,我们的综合方法为鉴定MLL重排白血病的主要共同驱动因素提供了一个平台,在这个平台上,可以解剖白血病前向白血病的转变和谱系可塑性,并测试新的治疗方法。
Fig2. 持续的miR-130b活性和NR2F6/SGMS1抑制是MLL-AF4+白血病维持所必需的
原文链接:
https://pubmed.ncbi.nlm.nih.gov/34111240/
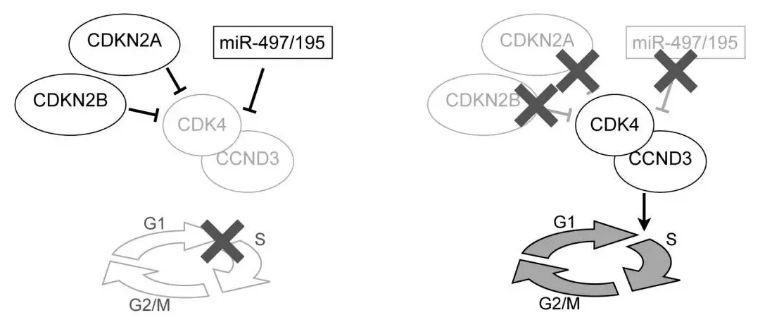
之前的研究确定了(移植到NOD/SCID小鼠中的)患者源性白血病细胞的快速植入与B细胞前体急性淋巴细胞白血病(BCP-ALL)早期复发的关联。为了寻找与该表型相关的细胞和分子图谱,本文研究了不同移植表型和患者预后中microRNAs (miRNAs)的表达,并发现移植缓慢的患者来源的异种移植样本中存在高miR-497/195表达,这些样本来自预后良好的患者。相比之下,在与早期复发相关的快速移植样本中,观察到这些miRNAs的表观遗传抑制和低表达。患者源性白血病细胞中miR-497/195的过表达抑制了白血病的体内生长,并延长了受试者的生存期。相反,抑制miR-497/195会导致白血病细胞生长增加。miR-497/195过表达导致了关键细胞周期调节因子被下调,本研究鉴定出CDK4/CCND3介导的G1/S转换控制是miR-497/195抑制BCP-ALL进展的主要机制。
在另一组独立的患者样本中的发现强调了miR-497/195介导的细胞周期调节的关键作用,表明miR-497/195的高表达以及 CDKN2A/B 的完整序列与极好的预后相关,而CDKN2A/B的缺失以及miR-497/195的低表达则与明显较差的无复发生存率相关。这些发现表明,细胞周期调节因子的协同缺失作为新的预后因子,暗示可能是小儿BCP-ALL的潜在治疗靶点。
Fig3. miR-497/195低表达和CDKN2A/B缺失同时发生促进白血病生长的机制示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/34098582/
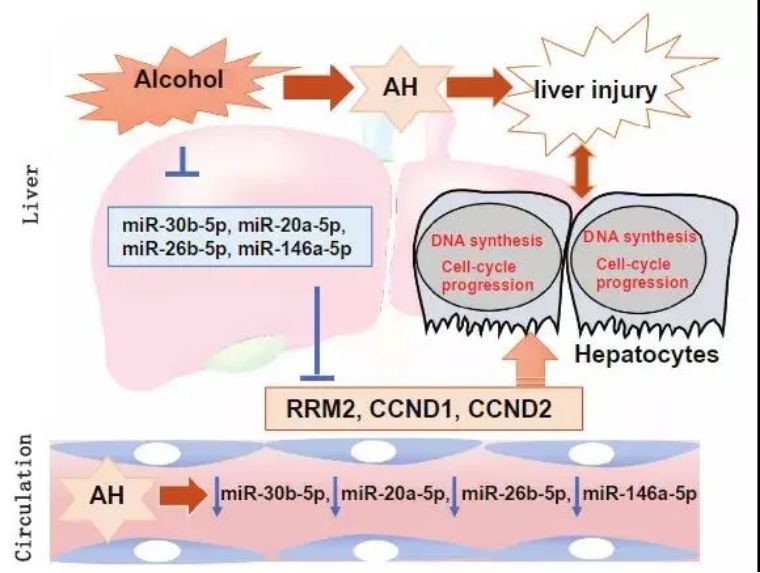
本研究进行了全面的血清转录组学分析,以探讨miRNA在酒精性肝炎(AH)发病机制中的作用及其预后意义。对15名对照、20名无肝病的重度饮酒者和65名AH患者进行了血清miRNA表达谱分析,并与公开可用的AH患者肝脏miRNA表达谱进行了比较。在前26个miRNAs中,miR-30b-5p、miR-20a-5p、miR-146a-5p和miR-26b-5p在AH患者的血清和肝脏中的表达均显著降低。对这些miRNAs的潜在靶点进行通路分析,发现了与DNA合成和细胞周期进程通路相关的基因,包括RRM2、CCND1、CCND2、MYC和PMAIP1。本研究发现在接受肝移植的AH患者中RRM2、CCND1 和 CCND2的蛋白表达显著增加,但MYC和PMAIP1的蛋白表达没有显著增加;miR-26b-5p和miR-30b-5p抑制RRM2和CCND2的3'-UTR荧光素酶活性,miR-20a-5p降低CCND1和CCND2的3'-UTR荧光素酶活性。在346天的中位随访期间,21% 的AH患者死亡;这些患者的BMI、MELD、血清miR-30b-5p、miR-20a-5p、miR-146a-5p和 miR-26b-5p高于存活患者。Cox回归分析显示BMI、MELD评分、miR-20a-5p、miR-146a-5p和miR-26b-5p预测死亡率。
结论:AH患者试图通过下调特定miRNAs和上调负责DNA合成和细胞周期进程的基因来应对肝细胞损伤。这些miRNAs的高表达表明肝再生能力减弱,预示着AH患者的短期死亡率。
Fig4. 选定的miRNAs在AH发病机制中的重要性示意图
原文链接:
https://pubmed.ncbi.nlm.nih.gov/34096637/
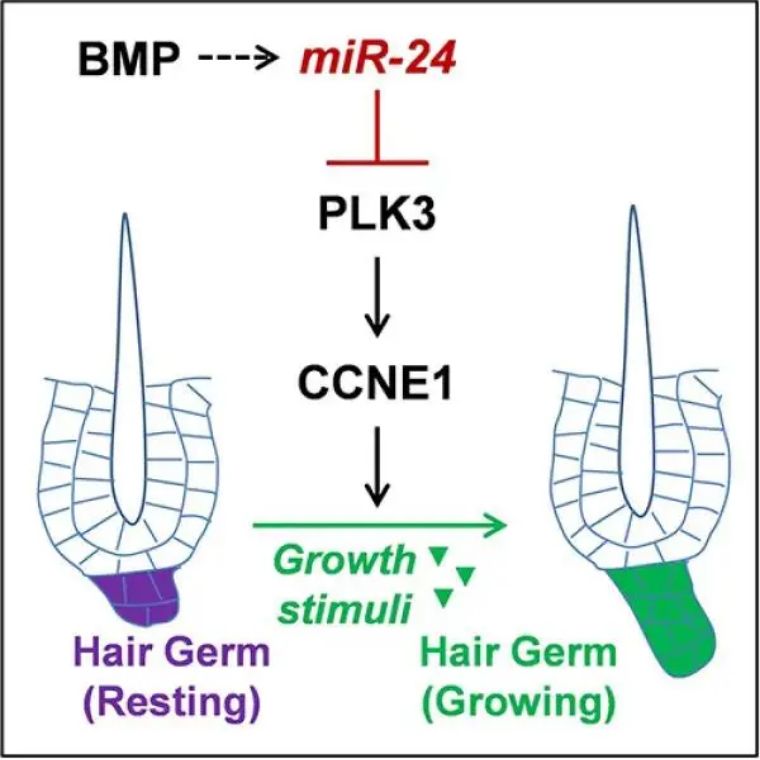
探索皮肤毛囊 (HF) 祖细胞对生长刺激的内在敏感性是如何动态调节的。我们发现miR-24是一种 在 HF 祖细胞中的表达与其体内生长能力呈负相关的miRNA。实验表明,它在成人皮肤上皮中的上调导致 HF 祖细胞对生长线索的反应迟钝并阻碍头发再生,而其条件消融导致 HF 祖细胞的超敏生长反应和早熟头发再生。从机制上讲,我们发现miR-24通过直接靶向限制了 HF 祖细胞的内在生长能力Plk3,其下调导致 CCNE1 表达降低,CCNE1 是进入细胞周期的关键细胞周期蛋白。这些发现揭示了 HF 祖细胞使用 miRNA 介导的动态和细胞内在机制,以使其再生能力适应不同的生理条件。
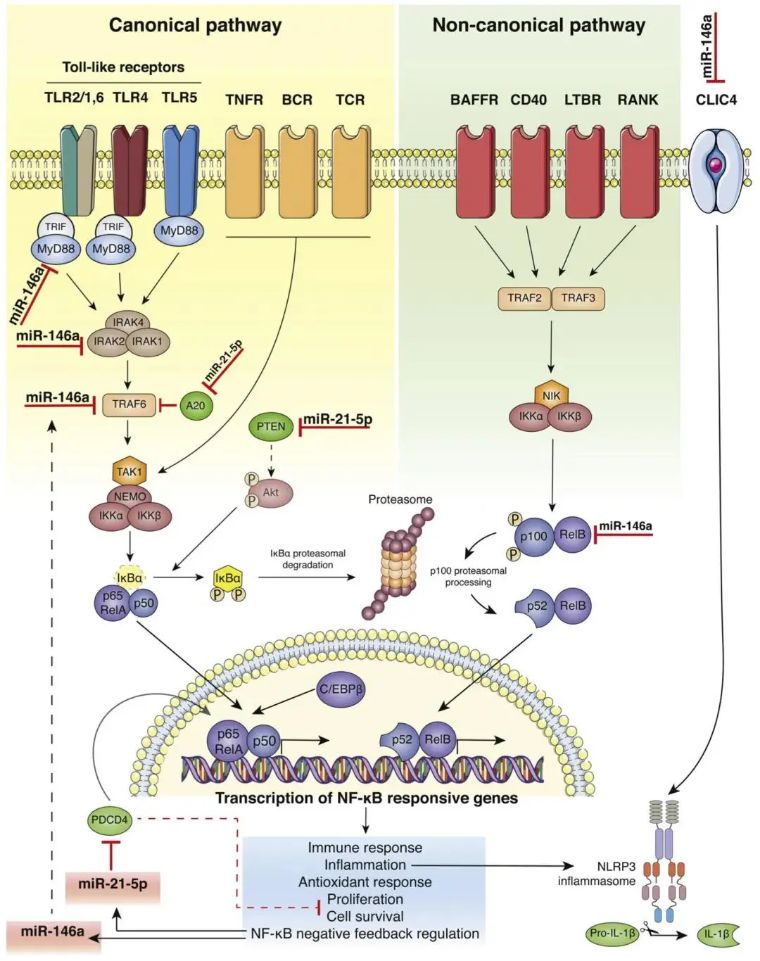
2001年发表的第一篇关于“炎症”的论文为一个统一的理论铺平了道路,该理论解释了衰老如何以及为何成为最常见的年龄相关疾病(ARDs)发展的主要风险因素。这个主题最令人兴奋的挑战是解释全身性炎症是如何随着年龄的增长而急剧增加的,以及为什么它在相同年龄的个体中表现出不同的发生率。过去二十年的“表观遗传革命”表明,对个体基因组成的评估不足以描绘与年龄相关炎症的轨迹。因此,科学家们一直关注非编码RNA(如microRNAs)在炎症中的作用。最近10年获得的结果支持了我们称为inflammamiRs的miRNA子集的关键作用,因为它们能够控制NF-κB驱动的炎症通路。本文综述中,作者将重点关注两种inflammamiRs,即miR-21-5p和miR-146a-5p,它们靶向多种属于NF-κB/NLRP3通路的分子。在衰老和ARDs的背景下,miR-146a-5p和IL-6之间的相互作用也将被强调。作者还将提供最相关的证据,表明循环inflammamiRs和 IL-6可以测量炎症程度。
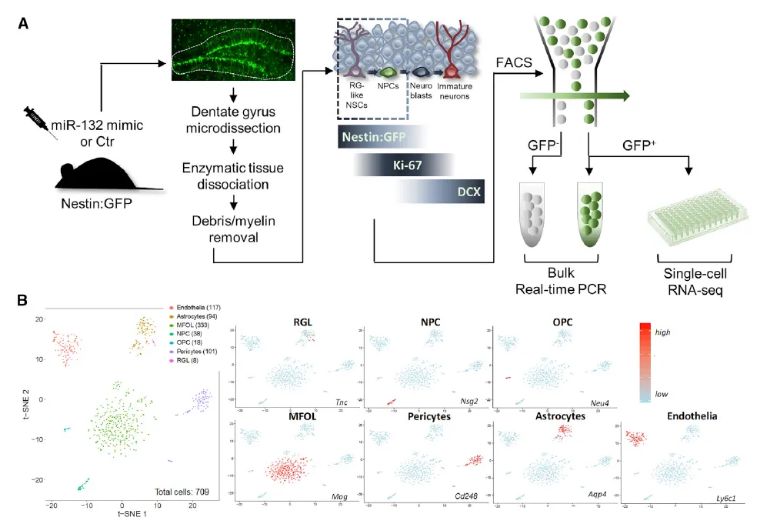
成人海马神经发生 (AHN) 在功能上与人类和啮齿动物的记忆和认知可塑性有关。在阿尔茨海默病 (AD) 中,海马神经源性生态位产生新神经元的过程受到阻碍,但所涉及的机制尚不清楚。在这里,我们确定 miR-132,AD 中最一致下调的 microRNA 之一,作为 AHN 的有效调节剂,在成体神经干细胞及其后代中发挥细胞自主神经原作用。使用不同的 AD 小鼠模型、培养的人类原代和已建立的神经干细胞以及人类患者材料,我们证明 AHN 直接受 AD 病理影响。成年小鼠 AD 海马体中的 miR-132 替代可恢复 AHN 和相关记忆缺陷。我们的研究结果证实了 AHN 在 AD 小鼠模型中的重要性,并揭示了靶向 miR-132 在神经退行性疾病中的潜在治疗潜力。

 命码生物是基于张辰宇教授原创发现“细胞外微小核糖核酸“稳定存在,具有独特的生物学功能”的科学规律,并在此基础上发展的基础研究、应用基础研究、转化研究及产业转化的生物医药高新科技企业。
命码生物是基于张辰宇教授原创发现“细胞外微小核糖核酸“稳定存在,具有独特的生物学功能”的科学规律,并在此基础上发展的基础研究、应用基础研究、转化研究及产业转化的生物医药高新科技企业。 江苏命码生物科技有限公司成立于2008年,是国内领先的专业从事miRNA基础研究、应用基础研究、转化研究和产业发展的生物医药高新技术企业
江苏命码生物科技有限公司成立于2008年,是国内领先的专业从事miRNA基础研究、应用基础研究、转化研究和产业发展的生物医药高新技术企业 江苏命码生物科技有限公司成立于2008年,是国内领先的专业从事miRNA基础研究、应用基础研究、转化研究和产业发展的生物医药高新技术企业
江苏命码生物科技有限公司成立于2008年,是国内领先的专业从事miRNA基础研究、应用基础研究、转化研究和产业发展的生物医药高新技术企业 江苏命码生物科技有限公司成立于2008年,是国内领先的专业从事miRNA基础研究、应用基础研究、转化研究和产业发展的生物医药高新技术企业
江苏命码生物科技有限公司成立于2008年,是国内领先的专业从事miRNA基础研究、应用基础研究、转化研究和产业发展的生物医药高新技术企业